हैलोजन तत्व
हैलोजन की परिभाषा :(halogens definition in hindi)
परिभाषा: ग्रीक भाषा में हैलोजन का अभिप्राय है- hals-sea salt; gennao- producer जिसका अर्थ है लवण बनाने वाले।
आवर्त सारणी के वर्ग 17 में स्थित कुल पाँच तत्वों फ्लोरीन (F),क्लोरीन (Cl), ब्रोमीन (Br), आयोडीन (I), एस्टेटीन (As) को सामान्यता हैलोजन कहते हैं क्योंकि इन सभी तत्वों के लवण समुद्री जल में बहुतायत से पाये जाते हैं। इनमें एक एस्टेटीन(As) रेडियो एक्टिव तत्व है।
हैलोजन की उपस्थिति (occurrence of halogens in hindi):
- उचित क्रियाशीलता के कारण यह मुक्त अवस्था में नहीं पाए जाते हैं। संयुक्त अवस्था में यह भू पर्पटी तथा समुद्री जल में पाए जाते हैं।
- समुद्री जल में यह सोडियम , पोटेशियम , कैल्शियम के क्लोराइड , ब्रोमाइड , आयोडाइड के रूप में पाए जाते हैं , समुद्री घास में यह कार्नेलाइट के रूप में पाए जाते हैं
- मुख्य हैलाइड खनिज फ्लोरसपार, टोपाज, क्रायोलाइट, सिल्वीन, कार्नेलाइट आदि हैं।
हैलोजन का इलेक्ट्रानिक विन्यास (electronic configuration of halogens in hindi):
इस वर्ग के सभी तत्वों के बाहरी कोश में 7 इलेक्ट्रॉन होते हैं। इनका इलेक्ट्रोनिक विन्यास निम्न है –
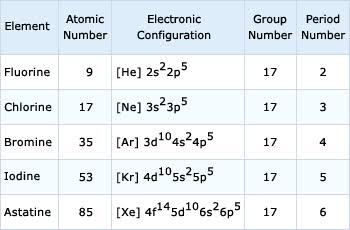
हैलोजन की भौतिक अवस्था (physical state of halogens in hindi):
- सभी हैलोजन तत्व अध्रुवीय,सह संयोजक, द्विपरमाणविक अणुओं के रूप में पाये जाते है। जैसे- F2
- यह अणु आपस में दुर्बल वाण्डरवाल्स बलों द्वारा जुड़े रहते हैं। परमाणु आकार तथा अणु भार बढ़ने के साथ-साथ इन बलों का मान भी बढ़ता है। अतः F2, Cl2, गैस; Br2 द्रव तथा I2 ठोस अवस्था में पायी जाती है।
- फ्लोरीन तथा क्लोरीन हरे पीले रंग की गैसें हैं ,ब्रोमीन लाल भूरे रंग का वाष्पशील द्रव है जबकि आयोडीन बैंगनी रंग का ठोस है।
- सभी हैलोजन रंगीन होते हैं क्योंकि सूर्य के प्रकाश में दृश्य क्षेत्र से भी किरणों को अवशोषित कर लेते हैं जिससे इलेक्ट्रॉन निम्न ऊर्जा के कक्षको से चले जाते हैं , जब भी यह इलेक्ट्रॉन वापस ऊर्जा के कक्षाओं में जाते हैं तो दृश्य क्षेत्र में प्रकाश विकिरणों को उत्सर्जित करते हैं अतः यह रंगीन दिखाई देते हैं।
- ऊपर से नीचे जाने पर गलनांक व क्वथनांक बढ़ते जाते हैं।
- सभी हैलोजन द्विपरमाण्वीय अणु है।
इलेक्ट्रॉन बन्धुता तथा विद्युत ऋणात्मकता में अन्तर :
इलेक्ट्रॉन बन्धुता में उदासीन परमाणु एक अतिरिक्त इलेक्ट्रॉन ग्रहण करके ऋण आयन बनाता है और ऊर्जा मुक्त करता है, जबकि किसी तत्व की विद्युत ऋणात्मकता, सहसंयोजी बंद के इलेक्ट्रॉन की अपनी ओर आकर्षित करने की क्षमता को व्यक्त करती है। परमाणु आकार घटने पर इलेक्ट्रान बंधुता घटती है। अक्रिये गैसों की इलेक्ट्रान बन्धुताएं शून्य होती हैं।
गैसीय अवस्था में किसी परमाणु के बाह्य कक्ष में एक इलेक्ट्रान प्रवेश कराने के लिए जितनी ऊर्जा मुक्त होती है। उस परमाणु की इलेक्ट्रान बंधुता कहलाती है।
हैलोजन के सामान्य गुणधर्म (General properties of halogens in hindi):
- हैलोजन तत्वों के वर्ग में ऊपर से नीचे जाने पर नाभिकीय आवेश घटने के कारण परमाणु तथा आयनिक त्रिज्या का मान बढ़ता है जबकि आयनन उर्जा का मान वर्ग में ऊपर से नीचे जाने पर घटता है।
- प्रत्येक आवर्त में हैलोजन की विधुत ऋणता सबसे अधिक होती है क्योंकि प्रत्येक आवर्त में इनका आकार छोटा व प्रभावी नाभिकीय आवेश सबसे अधिक होता है
- हैलोजनों की इलेक्ट्रॉन बंधुता वर्ग में नीचे की ओर जाने पर पहले क्लोरीन तक बढ़ती है फिर घटती है। ज्ञात तत्वों में क्लोरीन की इलेक्ट्रान बंधुता सबसे ज्यादा होती है। फ्लोरीन की नहीं।
- क्योंकि फ्लोरीन का आकार छोटा व प्रभावी नाभिकीय आवेश सबसे अधिक होता है। जिस के कारण उसमें इलेक्ट्रान घनत्व अधिक होता है और इलेक्ट्रान बंधुता घट जाती है।
- क्लोरीन(Cl) का परमाणु आकार बडा होने के कारण इस पर इलेक्ट्रॉन का घनत्व कम होता है जिससे आने वाला इलेक्ट्रॉन कम प्रतिकर्षित होता है , दूसरे शब्दों में इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति अधिक होती है अतः इलेक्ट्रॉन बंधुता अधिक होती हैं
- इलेक्ट्रॉन बंधुता का क्रम- Cl>Fl>Br>I (नोट : आवर्त सारणी में सबसे अधिक विधुत ऋणता F की है।)
- विद्युत ऋणात्मकता का मान वर्ग में ऊपर से नीचे जाने पर घटता है। ज्ञात तत्वों में F की विद्युत ऋणात्मकता सबसे ज्यादा होती है।
- हैलोजन परिवार के सभी तत्व अधातु है। वर्ग में ऊपर से नीचे जाने पर धात्विक गुण बढ़ता है इसी कारण आयोडीन में कुछ धात्विक गुण पाए जाते हैं। इसमें धातुई चमक पायी जाती है।
- हैलोजन अणु अध्रुवीय होते हैं।अतः ये ध्रुवीय विलायको में अच्छी प्रकार से विलेय नहीं होते हैं।
- सभी हैलोजन एक संयोजक या द्विसंयोजक धातुओं से क्रिया करके सामान्यतः आयनिक हैलाइड बनाते हैं।
- सभी हैलोजन अधातुओं से क्रिया करके सामान्यतः सह-संयोजक हैलाइड बनाते हैं।
- सभी हैलोजन हाइड्रोजन से क्रिया करके सामान्यतः सह-संयोजक हाइड्रोजन हैलाइड बनाते हैं।
फ्लोरीन का असंगत व्यवहार (abnormal behavior of fluorine in hindi):
फ्लोरीन के गुण इसके वर्ग के अन्य तत्वों से भिन्न होते हैं। इसके असंगत व्यवहार का कारण उसका छोटा आकार, उच्च विद्युत ऋणात्मकता, निम्न वियोजन ऊर्जा तथा d कक्षकों अनुपस्थिति का होना है।
निम्न बिदुंओ से इसके असंगत व्यवहार की पुष्टि होती है-
- फ्लोरीन की अधिकतम विद्युत ऋणात्मकता होने के कारण यह केवल -1 ऑक्सीकरण अवस्था प्रदर्शित करती है जबकि अन्य हैलोजन -1 से +7 तक ऑक्सीकरण अवस्था प्रदर्शित करते हैं।
- वह हैलोजन जिनमें खाली d कक्षक होते हैं वह +3 , +5 , +7 ऑक्सीकरण अवस्था दर्शाते हैं, ऑक्सीकरण अवस्था में जैन नियम इलेक्ट्रॉनिक विन्यास दर्शाते हैं।
- HCl ,HBr तथा HI की अपेक्षा HF दुर्बलतम अम्ल है।
- d कक्षको की अनुपस्थिति के कारण फ्लोरीन केवल 1 सहसंयोजकता प्रदर्शित करता है।
- HCl ,HBr तथा HI एक क्षारीय (monobasic) जबकि HF द्विक्षारीय (diabasic) है।
- फ्लोरीन में अधिकतम आयनिक गुण होते हैं।
- आवर्त सारणी में सबसे अधिक विधुत ऋणता F की (-1) है क्योंकि इसका आकार छोटा व प्रभावी नाभिकीय आवेश सबसे अधिक होता है।
क्लोरीन (Chlorine in hindi):
- इसकी खोज शीले (Sheele) ने 1774 मे की थी।
- प्रयोगशाला में क्लोरीन का निर्माण मैंगनीज डाइऑक्साइड को सांन्द्र HCl के साथ गर्म करके किया जाता है। 4HCl (aq) + MnO2(s) → 2H2O(l) + MnCl2(aq) + Cl2(g)
- औद्योगिक स्तर पर क्लोरीन का निर्माण डीकन विधि तथा ब्राइन के विद्युत अपघटन द्वारा किया जाता है।
- यह तीखी (pungent),गंध की विषैली तथा दम घोटने वाली गैस है।
- नमी की उपस्थिति मे यह गैस विरंजक (Bleaching) का कार्य करती है। यह रंगीन फूल पत्तियों, रंगीन कपड़ो तथा अन्य कई रंगीन वस्तुओं का रंग उड़ा देती है।
क्लोरीन के उपयोग (uses of chlorine in hindi)
- ऑक्सीकारक के रुप में।
- विरंजक पाउडर (Bleaching powder) के निर्माण में।
- कीटनाशक के रुप में।
- रोगाणुनाशक के रुप में।
- DDT, गैमेक्सीन,क्लोरोफार्म,प्लास्टिक आदि महत्वपूर्ण रसायन बनाने में।
- यह गैस फूलों का रंग उड़ा देती है।
- क्लोरीन गैस चूने के साथ प्रतिक्रिया कर ब्लीचिंग पाउडर का निर्माण करती है। ब्लीचिंग पाउडर एक हल्के पीले रंग का चूर्ण है, जिसमें क्लोरीन की गंध आती है।
ब्रोमीन (Bromine in hindi):
- सर्वप्रथम बैलार्ड (Balard) ने 1811 में इसकी खोज की।
- प्रयोगशाला में यह गैस मैगनीज डाइऑक्साइड तथा KBr मिश्रण को सांद्र सलफ्यूरिक एसिड के साथ गर्म करके प्राप्त की जाती है।
- ब्रोमीन गहरे लाल रंग का भारी द्रव है। ब्रोमीन साधारण ताप पर गहरे लाल बादामी रंग के द्रव के रूप में पाया जाता है। इसमें से लाल रंग का तीव्र गंध का विषैले धुआं उठता रहता है। इस के संपर्क में आने पर त्वचा गल जाती है तथा घाव हो जाते हैं।
- ब्रोमीन एक द्रव अधातु (Liquid Non Metal) है। समुद्री जल में ब्रोमीन, सोडियम, पोटैशियम एवं मैग्नीशियम के ब्रोमाइड के रूप में पाया जाता है।
- भारत में कच्छ के रण (Rann of Kutch) में पाया जाने वाला ब्राइन ब्रोमीन का एक बहुमूल्य स्रोत है।
ब्रोमिन के उपयोग (uses of bromine in hindi):
- प्रयोगशाला में अभिकर्मक के रूप में।
- ऑक्सीकारक के रूप में।
- विरंजक के रूप में।
- रंजक पदार्थ (Dye stuff) बनाने में।
- जीवाणु नाशक के रूप में।
- ब्रोमीन जल कार्बनिक यौगिकों की असंतृप्त प्रकृति का परीक्षण करने में।
- ब्रोमीन स्टार्च विलयन में घुलकर नारंगी पीला रंग देती है।
आयोडीन (Iodine in hindi):
- सर्व प्रथम कोर्टोइस (Courtois) ने 1811 में आयोडीन की खोज।
- प्रयोगशाला में यह गैस मैगनीज डाइऑक्साइड तथा KI मिश्रण को सांद्र सलफ्यूरिक एसिड के साथ गर्म करके प्राप्त कीजाती है।
- बैंगनी रंग की वाष्प होने के कारण ही इसे आयोडीन (Gr; ioeides = बैंगनी) कहा जाता है।
- आयोडीन कार्बनिक यौगिको जैसे- बेंजीन, क्लोरोफॉर्म, कार्बन टेट्रा क्लोराइड आदि में घुलकर बैगनी रंग का विलयन बनाती है।
- आयोडीन का प्रमुख स्रोत चिली (द० अमेरिका) में पाया जाने वाला सोडियम नाइट्रेट का निक्षेप है।
- लैमिनेरिया (Laminaria) किस्म के समुद्री घासों (एक प्रकार का शैवाल) में आयोडीन प्रचुर मात्रा में पाया जाता है। इस समुद्री घास को अच्छी तरह सुखाने के पश्चात गहरे गड्ढों में सावधानीपूर्वक जलाने से जो राख (Ash) प्राप्त होती है, उसे केल्प (Kelp) कहते हैं। इसी केल्प में आयोडाइड के रूप में आयोडीन की मात्रा 0.4% से 1.3% तक रहती है। हैलोजनों में आयोडीन प्रबलतम ऑक्सीकारक है।
आयोडीन के उपयोग (uses of iodine in hindi):
- प्रयोगशाला में आयोडोफार्म परीक्षण करने के लिए।
- आयोडीन के यौगिक औषधियों के रुप में प्रयोग किये जाते हैं।
- ऑक्सीकारक के रुप में।
- आयतनात्मक विश्लेषण में।
- आयोडीन का कोलॉयडी विलयन ‘घेंघा’ रोग के इलाज मे प्रयुक्त होता है।
- आयोडीन एक प्रबल जीवाणुनाशी है, अतः इसका प्रयोग टिंचर आयोडीन बनाने में होता है। आयोडीन और इथाइल ऐल्कोहॉल का मिश्रण टिंचर आयोडीन कहलाता है।
एस्टेटीन (Astatine): एस्टेटीन एक रेडियोसक्रिय तत्व है जो अत्यंत ही अस्थायी होता है। यह ठोस अधातुओं में सबसे भारी तत्व है। यह भू-परत में सबसे कम मात्रा में पाया जाने वाला तत्व है।
अन्य विशेष जानकारी:
- कांच पर लिखने के लिए हाइड्रोफ्लुओरिक अम्ल का उपयोग किया जाता है।
- फ्लुओरीन (Fluorine) का उपयोग UF6, तथा SF6, बनाने में होता है, जिनका क्रमशः परमाणु ऊजf उत्पादन एवं परावैद्युतिकी में इस्तेमाल किया जाता है।
- क्लोरीन डाइऑक्साइड (CIO2) तथा क्लोरीन के मिश्रण को यूक्लोरीन कहते हैं।
- क्लोरीन द्वारा किसी पदाथf कr fवरंजीकरण करने के पश्चात क्लोरीन की आधिक्य को समाप्त करने के लिए प्रयोग किया गया पदार्थ प्रतिक्लोर कहलाता है।
- डाईक्लोरो डाईफ्लोरो मीथेन (Dichlorodifluoro Methane) को फ्रिऑन कहा जाता है। इसका उपयोग प्रशीतक (Refrigerant) के रूप में होता है।
- हाइड्रोक्लोरिक अम्ल को म्यूरेटिक अम्ल (Muratic Acid) कहा जाता है।
इस विषय से सम्बंधित यदि आपका कोई सवाल या सुझाव है, तो आप उसे नीचे कमेंट में लिख सकते हैं।
Good
So good
Nice
Thanks
Very good explanation 👌👌
Yes friend
Aestetin ko helogen kyo nahi kahte h